转自:药渡

PART.
01
前言
核药,即放射性药物,由放射性同位素与有机靶向药物组合而成。根据用途可分为诊断型核素药物和治疗型核素药物。
诊断型核药常采用发射γ射线的放射性同位素,能被特定仪器SPECT/PET检测到,主要应用于无创精准靶向全身动态诊断、影像病况分级、用药效果评估等。治疗型核药采用发射短程的α或者β粒子,通过参与代谢过程或经标记分子引导在病变组织聚集并进行辐照,对局部的病变细胞产生DNA损伤,从而抑制或破坏病变组织发挥其治疗作用。
随着癌症、心血管慢性病、神经系统疾病等对早期诊断以及精准治疗的高需求,近年来核医学“翻红”成为“明星”学科。精准医疗概念的推广,使得国内外医药行业逐渐重视核药在疾病诊断和治疗中的核心地位,促进了新型核药开发的异军突起。因此,对于快速发展导致的问题及挑战进行科学讨论及应用开发方面的探索具有重大的现实意义。
PART.
02
国内外核药开发的
历史和技术挑战
1898年居里夫人发现放射性钋和镭元素到现在已有100多年,人类从此开始了有关放射性元素应用于医疗方面的研究。1905年居里夫人使用镭针进行了第一例放射性同位素插入治疗。1951年,美国FDA批准碘化钠I-131用于甲状腺患者。1962年,David Kuhl发明了重建断层摄影术,即SPECT和PET。1971年,美国医学协会正式承认核医学为医学专业,此后核药进行了一系列的发展和开发迭代。
截止目前美国FDA共批准51种放射性药物,涉及核素种类共18种。其中99mTc标记药物17种,18F标记药物6种。而我国上市放射性药品在数量、标记核素的种类以及创新速度上远远落后于美国。迄今为止我国药品监管部门共批准31种放射性药品上市,涉及标记核素10种,其中99mTc标记药物13种,18F标记药物1种。在已批准上市的放射性药品中,核药品种与国外大致相同,但治疗性核药少且普遍缺少自主知识产权。
目前全球放射性药物正处于高速增长阶段,其市场规模高达70亿美元(诊断药为主),2030年预计约为300亿美元(治疗药为主)。随着FDA批准用于神经内分泌肿瘤治疗的177Lu-DOTATATE和用于转移性前列腺癌治疗的177Lu-PSMA-617在临床应用和市场领域取得的巨大成功,靶向放射性核素治疗(TargetedRadionuclide Therapy,TRT)和放射性核素偶联药物 (Radionuclide Drug Conjugates, RDC) 获得了科研和产业界的广泛关注。
用于治疗的医用放射性核素可以分为β粒子发射核素、α粒子发射核素和俄歇电子发射核素。目前β粒子发射核素应用最广泛,继2010年FDA批准α疗法223Ra-RaCl2用于骨转移的姑息性治疗后,α核素药物的临床应用预计将有快速发展。β粒子是高能电子,产生较低的线性能量转移(linear energy transfer,LET),约为0.2 keV/µm,在组织中释放的能量在30 kV-2.3 MeV。α粒子是天然的氦核(两个质子加两个中子),与β粒子相比穿透性能较低,在组织中的穿透范围为50-100 µm。由于其质量更大从而产生更高的LET(50-230 KeV/µm),释放的能量也更多(5-9 MeV)。研究表明约一万个β粒子的累积剂量可以对单个癌细胞产生致命作用,而少至千分之一的α粒子就可以达到同样的效果。以上性质使发射α粒子的核素药物有几个显著的优点:首先是辐射剂量在靠近衰变部位的局部沉积,较少的分子就可以产生显著的生物效应,适合治疗单细胞转移和小肿瘤病变,可有效避免β核素治疗中存在的逃逸现象。第二是α粒子在组织中穿透距离短可以降低对周围健康组织的损伤,这是β发射核素经常出现的一个缺陷。第三是α粒子高治疗效能使得每位患者的单剂量给药量更低(例如,225Ac-PSMA-617常用剂量为7.4 MBq vs 177Lu-PSMA-617常用剂量为7.4GBq),可以减少潜在的非靶标副作用和降低用药成本。
α核素类放射性药物作为新兴的疗法,正在引领核药领域的下一波创新浪潮。目前研究较多的发射α粒子放射性核素包括Tb-149,At-211,Bi-212,Bi-213,Ac-225和Th-227,其衰变性质如下表所示。At-211为非金属卤族元素,其余均为金属核素。
表1. 医用α粒子发射核素的衰变性质
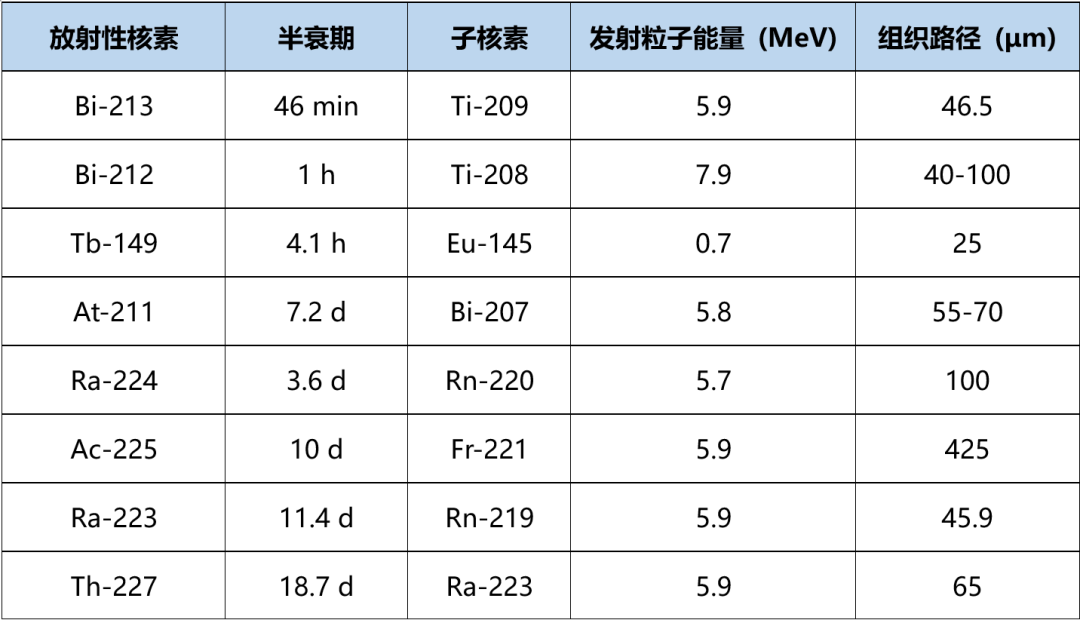
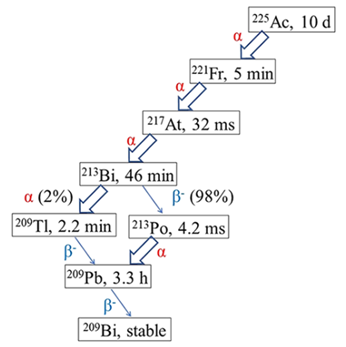
Ac-225具有优良的核性质,是目前发射α粒子金属放射性核素研究的热点(表1)。Ac-225半衰期为9.92天,同抗体类靶向载体的生物体内动力学过程兼容。Ac-225的衰变链中发射5个α粒子(图1),使母核素对靶部位的辐射剂量大,生物效应显著。多次衰变带来的负面问题是每个子核素具有不同的化学性质,特别是Bi-213(t1/2 = 46 min)和Pb-209(t1/2 = 3.2 h),会导致核素从药物上泄露,积聚在非目标器官而损害健康组织。
PART.
03
核药开发中的短板
及行业痛点
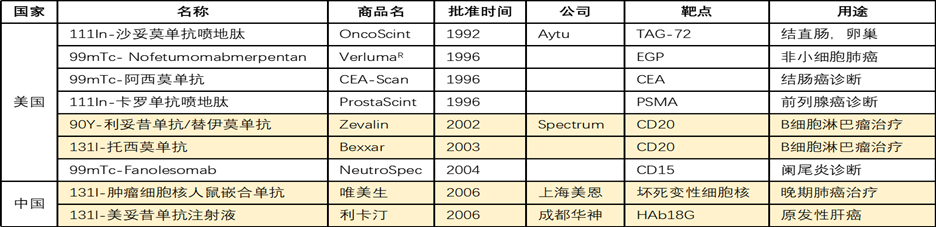
放射性核素产生的电离辐射能够杀死肿瘤细胞也能杀死正常细胞,而核药副作用主要就是正常组织器官受到辐射损伤。换言之,核药既能有神奇的疗效,也可能有严重的副作用。177Lu-DOTATATE和177Lu-PSMA均是以肽为靶头(ligand)的RDC药物,由于其分子量相对较小,体内生物半衰期较短,血液及正常器官辐射损伤也就不明显。但这两个药物的成功,偶然性大于必然性,与多肽相比,抗体亲和力更高,靶头库更全(可以通过免疫获得,且市场上已有很多针对各种靶点的单抗、双抗),抗体RDC的前景也更加广阔。但抗体分子量大,体内生物半衰期长,肿瘤的穿透性差,如果不能有效解决ligand稳定性、组织器官分布和鳌合稳定性等痛点问题,药物的副作用会变得无法承受。这些已在二十多年来多款上市抗体RDC药物的临床应用中得以证实,多数药物已少有销售或退市。
表2. 已上市抗体类放射性药物(标黄为治疗药)
与ADC不同的是,RDC药物中无论核素是否释放,其电离辐射都一直存在。核素走到哪里,电离辐射就照到哪里。加之β和α粒子杀伤力大,因此,核药如果靶向性不够或非靶组织器官摄取高或药物稳定性不好,副作用比ADC更危险且更严重。其副作用主要来源于抗体生物半衰期长血液毒性大以及Ligand脱靶引起其它器官毒性的问题,也可能来源于linker与Ligand偶联相互作用影响PKPD所造成器官“毒”的问题,或者核素与Chelator不匹配在活体内不稳定造成核“泄漏”影响成药性的问题。
分析起来,当前核药行业有五大技术痛点:
1、治疗核素生产主要依靠反应堆,造成治疗核素种类少,生产成本高。特别是国内核素生产与制备均缺乏硬件与成熟工艺,国产化困难。国内原创放射性药物研发能力不足,与国外先进水平差距较大。
2、Chelator不能室温标记较大尺寸的治疗性核素。目前常用的DOTA类螯合剂在螯合治疗性核素时往往需要加热,因此会影响Ligand的活性(抗体类靶头RDC影响尤其明显),增加脱靶风险 。
3、Chelator螯合核素不牢,导致标记后的核药不稳定,引起核“泄漏”使得游离的治疗性核素掉入血中并沉积于骨,对骨髓形成辐照损伤。
4、一旦药物结构定型后PKPD不能系统性调整,放射性药物集中分布在少数组织器官,致使高剂量辐照损伤,造成器官“毒”。
5、靶点同质化,内卷严重,主要集中在PSMA和SSTR两个靶点。仅国内30余家核药企业中,PSMA就有19个在研项目(7个IND), Dotatate十余个(5个IND )。而前列腺癌在国内为小癌种,神经内分泌肿瘤为罕见病。
因此,RDC“核导弹”最重要需改进的因素不是制导而是核控释,难点是如何减少器官“毒”和防止核“泄露”。金属核素的标记通常需要使用双功能螯合剂(bifunctional chelator,BFC),其中含有螯合结构、连接子和偶联基团(通常与多肽或单抗序列中特定氨基酸官能团如-NH2或-SH基团反应)。理想的BFC需要具备以下性质:首先,应该在温和的条件下迅速结合放射性金属核素,由于放射性衰变在标记过程中不断发生,如果标记过程缓慢则导致产品产量减少,此外一些生物靶向载体仅在生理pH值附近和37℃以下稳定,因此需要在这些条件下实施放射性标记,标记时间过长还会增加载体由于核素放射性导致的辐射自分解或活性改变的风险;第二,形成的金属复合物必须具有足够的稳定性,以防止体内放射性金属释放,这在防止游离核素的毒性方面起着关键作用。第三,对α核素衰变中的次生原子亦有较强的络合作用。
BFC开发中的连接子和偶联部分可以借鉴ADC和PDC药物开发中的经验,例如在连接子中引入可通过肾刷缘酶切割的片段增加标记化合物从肾脏的清除速度,在偶联部分的开发中可采用定点偶联技术以提高成药性;于抗体修饰中预留连接位点,更好地控制抗体上连接可标记基团的数量和位置等等。
BFC中的螯合结构用于结合金属离子。临床批准的放射性药物中使用的螯合结构大多数都是1,4,7,10-四氮杂环十二烷-1,4,7,10-四乙酸(DOTA)或二乙烯三胺五乙酸(DTPA)及其衍生物。大多数正在进行的Ac-225标记结构的临床试验也使用DOTA作为螯合配体,考虑到该结构的商业可及性和已获FDA批准的前体结构评价数据的可用性,这种开发策略是合理的。Ac-225可以与DOTA及其衍生物形成较稳定的络合物,并且与非环状螯合剂(如EDTA和DTPA衍生物)相比具有较好的体内稳定性,但是仍存在相当数量的体内脱标现象。更不利的是使用DOTA进行放射性标记通常需要高温(大于65℃)和/或延长反应时间,这一特征并不适应于热敏感载体(例如抗体)的标记。为了解决这个问题,两步标记方法被开发出来:先将Ac-225加热标记到游离的含DOTA的BFC上(如DOTA-Bn-NCS),然后再将BFC连接到活性配体上。两步法存在的问题是放射化学产量很低(≤10%)、产品比活度低、生产工艺复杂,难以适用于药物商业化生产。
表3. 离子半径越大,电荷变化越大,对Chelator要求越高
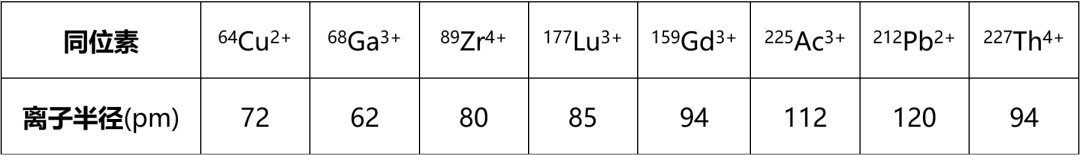
适用于锕系和镧系等大尺寸金属离子的理想螯合结构尚未确定,这与该类金属核素的配位化学固有挑战有关(表3):大半径导致较小的电荷密度削弱了它们与供体的静电相互作用,而且需要螯合结构提供尺寸较大的配位腔和多个供电子原子。而对用于治疗性放射性药物的螯合结构,还有一个额外的要求:需要同合适半衰期的诊断性放射性核素也有良好的螯合性质,以便开发配对使用的诊断用药显像剂。鉴于Ac-225等大尺寸放射性金属核素重要的诊断和治疗潜力,新螯合结构的研究近几年也得到了关注,相关研究成果被密集报道(见参考文献)。其中18元冠状结构Macropa来源于镧系金属螯合剂,被证实可以在室温下高效标记Ac-225,但是仍然存在一些缺陷:首先是Macropa只能结合镧系和锕系核素,不能够同时结合目前广泛使用的诊断核素而形成对药,也无法配位结合Ac-255衰变子核,因此不能有效地改善标记化合物对非靶器官的副作用。其次是Ac-225标记的Macropa会浓集于肝脏中,因此标记化合物的体内代谢产物可能也会产生一定的副作用。多个研究团队以Macropa为基础开发了多个新型螯合结构,使其更适用于放射性药物的研发,但是目前尚未有临床应用的相关报道。
PART.
04
核药发展的机遇和
Larm解决方案
Ligand、linker、Chelator、Radionuclide是核药技术四要素。做好核药是一项系统工程,而其中Chelator起到极为关键的作用。2021年成立的思锘新药创始团队在前期研究的基础上,研发了新型大环螯合结构Larm。Larm是LargerMacrocyclics的缩写,其结构是一系列十二元以上环状或螺环状的带有不同数量分支的金属核素螯合基团。Larm主体环上含有多个O、N、P、S等配位原子,可以满足不同核素配位数的需要;且主体环状结构上能够接出多个分支,可以通过linker连接不同的靶向活性配体并具有代谢调节功能的化学结构。
Larm结构的优势包括:采用较大尺寸环形分子设计,在保留高配位数的同时,环状结构具有一定柔性,金属离子容易进入并被稳定配位。常温下标记效率高、适用核素种类多、产物稳定;环外的可修饰位点多,可通过分支结构连接不同的功能片段,例如可以通过多倍体修饰提高化合物靶向摄取和滞留性、通过穿膜肽提高细胞内化率、通过白蛋白亲和片段延长体内滞留;通过功能片段的组合可以开发系列药物性质渐变的候选化合物,满足不同靶向药物的需求;Larm结构金属核素标记部分位于分子的中心,还有利于进一步提高标记化合物的稳定性。
Larm独特“核素舱”结构设计,螯合更牢固,分子更稳定:
目前思锘新药已经利用Larm结构构建了一系列结构新颖的候选化合物,活体分子影像生物评价研究表明新构建化合物的靶器官摄取和生物体内代谢性质都显著高于采用DOTA或NOTA为螯合剂的对照化合物,有待进一步的临床试验验证。除了自主开发的品种外,思锘新药还致力于将Larm系列螯合剂开发为放射性金属核素标记平台技术。通过广泛的国内外合作开展行业技术整合,改进核药成药性的底层核心技术,从而推动新型放射性药物的研发创新。
PART.
05
结语及核药行业展望
核药经过了百年的的发展历史,核素的医疗应用生产和监管逐渐趋于成熟。近年来, RDC药物的发展为肿瘤诊疗药物提供了一条新的赛道。相较于热门靶标渐显拥挤的ADC药物,这条在核药高壁垒下的新赛道无疑带给了众多“核”相关企业发展的好机会。对中国而言,核医学市场处于快速增长阶段,与欧美国家相比仍有较大差距,不管是硬件设施的更新还是核药研发力量的增强都还有更长的路要走。
核药的生产特性给了国内现有核药企业很好的保护,使得多数核药企业仍在诊断药为主的黄海上航行。而Larm类的新技术之船结合AI产生的医疗大数据一定会引领核药研发革命性的突破,新一代核药的研发将驶入蓝海和红海的国际航道,并将新型放射性药物的临床应用送入精准医疗之星辰大海。在追赶国际发展步伐的途中,开发出拥有自主知识产权的RDC新药将是全体核药人共同努力奋斗的目标。核心技术的创新将赋能我国核医疗产业具有广阔的发展前景。
参考文献(可上下滑动):
[1]Kelly JM, Amor-Coarasa A, Nikolopoulou A, Kim D, Williams C, Jr., Vallabhajosula S, et al. Assessmentof PSMA targeting ligands bearing novel chelates with application to theranostics: Stability and complexationkinetics of 68Ga3+, 111In3+, 177Lu3+ and 225Ac3+. Nucl Med Biol. 2017;55:38-46.
[2]Piramoon M, Khodadust F, Hosseinimehr SJ. Radiolabeled nanobodies for tumor targeting: From bioengineering to imaging and therapy [J]. Biochim Biophys Acta Rev Cancer, 2021, 1875(2): 188529.
[3]朱梦琴. 放射性核素标记PD-L1纳米抗体治疗非小细胞肺癌的体内外研究[D].安徽医科大学,2023.DOI:10.26921/d.cnki.ganyu.2023.001079.
[4]刘敬如,芮建中,朱虹.放射性核素标记的小分子FAP抑制剂的应用研究进展[J].同位素,2022,35(02):135-143.
[5]王正,徐建锋,蔡玉婷等.中国放射性药物的现状及发展趋势[J].中国食品药品监管,2018(07):44-49.
[6]J.Mather S .放射性药物研究的新领域[J].国际原子能机构通报,2003(01):62-65.
[7]刘伯里,金昱泰.中国体内放射性药物的现状与展望[J].核化学与放射化学,1989(04):229-235.
[8]α核素用于放射治疗:从基础放射化学到临床研究(第一部分). Poty Sophie;Francesconi Lynn C.;McDevitt Michael R.;Morris Michael J.;Lewis Jason S.;Yang Hui;Guan Zhiwei;Xu Baixuan;Department of Radiology and Program in Molecular Pharmacology; Memorial Sloan Kettering Cancer Center; New York; New York;Department of Chemistry; Hunter College; New York; New York; Graduate Center of City University of New York; New York; New York;Department of Radiology and Program in Molecular Pharmacology; Memorial Sloan Kettering Cancer Center; New York; New York; Department of Radiology; Weill Cornell Medical College; New York; New York;Department of Medicine; Memorial Sloan Kettering Cancer Center; New York; New York.中华核医学与分子影像杂志,2020
[9]王世真.我国核医学的现状与展望[J].核技术,1988(10):9-16.
[10] MEDraysintell Nuclear Medicine Report Edition 2022.
[11]Xu J.F.; Wang Z*, etc., Design, synthesis and preclinical evaluation of a novel bifunctional
macrocyclic chelator for theranostics of cancers. Europe Journal of Nuclear Medicine and
Mol ecular Imaging, 2022, 49:2618–2633.
[12] Xu J.F.; Wang Z*, etc., Screening and Preclinical evaluation of Novel Radiolabeled Anti-FAPαRecombinant Antibodies, Cancer Biotherapy & Radiopharmaceuticals, 2022.


